Pacient neudával bolesti na hrudi, neměl obtíže charakteru dušnosti v klidu. Při fyzikálním vyšetření byla z patologických nálezů přítomna nepravidelná srdeční akce, systolický šelest v oblasti srdečního hrotu, oslabené sklípkové dýchání při bazích plic a otoky dolních končetin kolem kotníků. Elektrokardiografie prokázala fibrilaci síní s přiměřenou komorovou odpovědí a deprese ST úseku ve svodech I, II, V5,6 a negativní vlny T ve svodech V1–5. Rentgen hrudníku ukázal zvětšení srdečního stínu (kardiothorakální index byl 0,55) bez známek plicní kongesce. Laboratorní vyšetření prokázalo významné zvýšení koncentrace natriuretického peptidu s hodnotou NT-proBNP přes 3000 pg/ml (norma < 125 pg/ml). Dále byla zvýšena koncentrace srdečního troponinu I (TnI) v krvi na 28 ng/l (norma < 20 ng/l). U pacienta byla indikována transthorakální echokardiografie prokazující těžkou dysfunkci významně dilatované levé komory s enddiastolickým rozměrem 67 mm (norma < 60 mm), s ejekční frakcí levé komory (EF LK) odhadem 20–25 %. Byla přítomna porucha kinetiky nejvíce v oblasti spodní stěny levé komory. Dále zjištěna středně významná funkční mitrální regurgitace, lehká trikuspidální regurgitace a nepřímé známky klidové plicní hypertenze s odhadem systolického tlaku v plicnici 45 mmHg.
Pacient byl přijat na lůžko koronární jednotky s pracovní diagnózou de novo srdeční selhání zřejmě na podkladě ischemické choroby srdeční. U pacienta byla po vyloučení nitrosrdeční trombózy jícnovou echokardiografií provedena úspěšná elektrická kardioverze s dosažením sinusového rytmu. Vzhledem k dynamickému vzestupu koncentrace troponinu I (TnI) na hodnotu 344 ng/l byla u pacienta indikována selektivní koronarografie, která prokázala významné aterosklerotické postižení všech tří věnčitých tepen včetně distální stenózy kmene levé věnčité tepny (ACS – arteria coronaria sinistra): dlouhé léze na ramus interventricularis anterior (RIA) se zúžením cévy až 70 %, postižení ramus circumflexus (RC) s uzávěrem jedné z marginálních větví (RMS 1), významné zúžení ramus intermedius (RIM – samostatná větev z kmene levé věnčité tepny – anatomická varianta) a postižení pravé věnčité tepny (ACD – arteria coronaria dextra), včetně její větve RIVP – ramus interventricularis posterior.
Byla doplněna nukleární magnetická rezonance srdce prokazující netransmurální ischemické ložisko v oblasti spodní a boční stěny levé komory se snížením ejekční frakce levé komory < 40 %. Vzhledem k těžké dysfunkci levé komory byla u pacienta provedena implantace defibrilátoru (ICD) v primární prevenci náhlé srdeční smrti (obr. 1 a obr. 2).
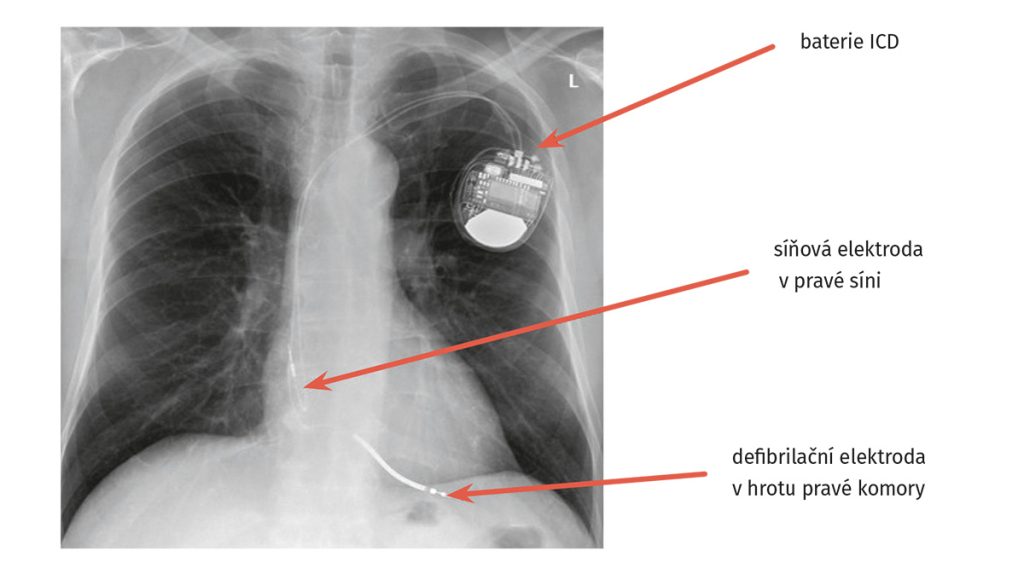
Obr. 1 Rtg hrudníku po implantaci defibrilátoru
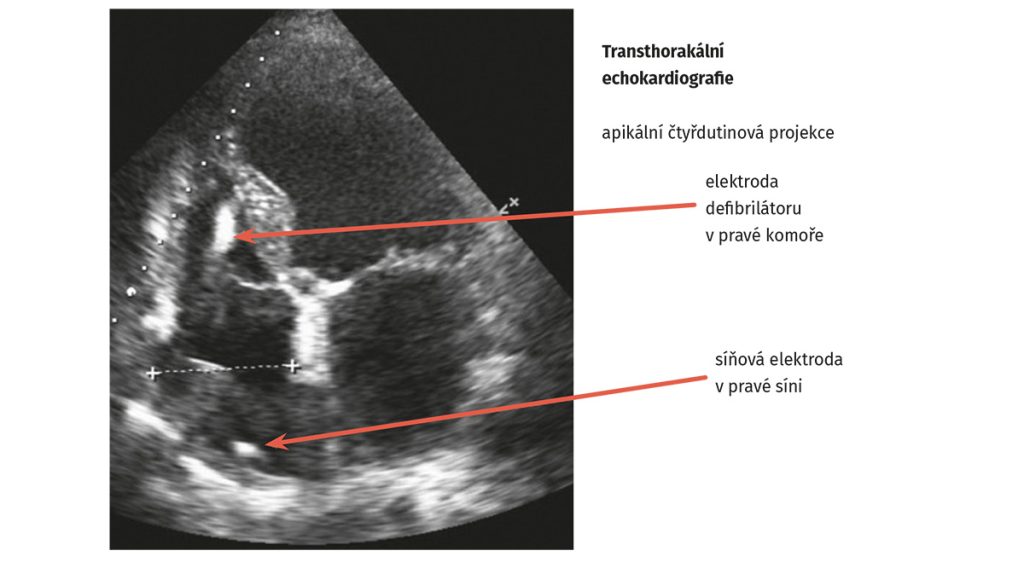
Obr. 2 Echokardiografie po implantaci defibrilátoru
Během hospitalizace byla zahájena farmakoterapie srdečního selhání zahrnující betablokátor metoprolol sukcinát v dávce 100 mg denně, inhibitor ACE ramipril v dávce 5 mg denně, spironolakton v dávce 25 mg, furosemid v dávce 20 mg, atorvastatin v dávce 80 mg denně a pokračovala antikoagulační terapie warfarinem. Byla doporučena titrace dávky betablokátoru a inhibitoru ACE. Během hospitalizace došlo ke klinickému zlepšení pacienta, byl bez dušnosti při běžných činnostech. Na indikačním semináři kardiocentra byla doporučena přímá revaskularizace myokardu čtyřnásobným aortokoronárním bypassem spolu s chirurgickou izolací plicních žil (MAZE procedura).
Pacient byl propuštěn ve stabilizovaném stavu do domácí péče a pozván ke kardiochirurgickému výkonu v druhé době. V květnu 2019 absolvoval čtyřnásobný aortokoronární bypass: RIA (LIMA – left internal mammary artery – tepenný štěp z levé vnitřní prsní tepny), RIVP + RMS + RIM autovenózně (žilní štěp pomocí v. saphena magna) a MAZE procedura (cryoMAZE – pomocí chladu).
Po operaci absolvoval pacient lázeňskou léčbu a byl předán do péče ambulantního kardiologa s kontrolami ICD v kardiocentru.
Pacient byl po výkonech dušný jen při větší zátěži, funkční třída NYHA II. Došlo ke zlepšení funkce levé komory s EF LK kolem 40 %.
Stav nemocného byl dlouhou dobu stabilizovaný až do února 2024, kdy pro postupné zhoršení dušnosti při zátěži vyhledal na doporučení praktického lékaře ambulanci kardiocentra. Pacient byl v té době schopen chůze pouze 100 metrů po rovině, klidové obtíže neměl, byl bez bolestí na hrudi. Byl ve funkční třídě NYHA III. Při fyzikálním vyšetření zjištěna nepravidelná srdeční akce a otoky dolních končetin. Došlo ke vzestupu hmotnosti o dva kilogramy.
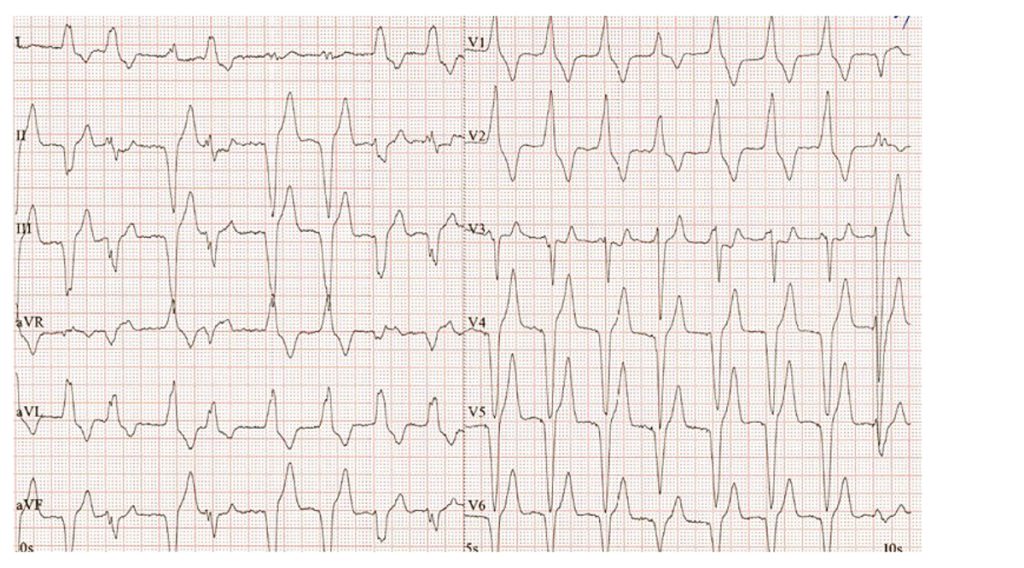
Obr. 3 EKG u pacienta se zhoršením srdečního selhání
Elektrokardiografie prokázala fibrilaci síní. Na obrázku je patrná komorová stimulace bez zřetelné pravidelné aktivity síní, se vzhledem blokády pravého Tawarova raménka a širokým QRS komplexem, četné komorové extrasystoly (obr. 3).
Laboratorní vyšetření ukázalo zvýšení koncentrace NT-proBNP na 1904 pg/ml, koncentrace kreatininu byla 106 µmol/l, odhad glomerulární filtrace 60 ml/min/1,73m2. Koncentrace hemoglobinu byla normální 157 g/l, kalemie byla 4,7 mmol/l, natrium 137 mmol/l. Provedená transthorakální echokardiografie ukázala pokles EF LK na 25 %. Po dohodě s pacientem byl změněna farmakoterapie – přerušena léčba ramiprilem a nově indikován sakubitril/valsartan v úvodní dávce 49/51 mg dvakrát denně a dále inhibitor SGLT2 empagliflozin v dávce 10 mg denně. U pacienta byl indikována elektrická kardioverze a rekoronarografie. Rekoronarografie prokázala průchodné bypassy bez výraznější progrese koronární aterosklerózy nativních tepen (obr. 4). Pacient podstoupil úspěšnou elektrickou kardioverzi na sinusový rytmus, respektive sekvenční stimulaci kardioverterem-defibrilátorem (ICD). Ta se jevila jako nevýhodná při stimulaci pravé komory, proto bylo u pacienta rozhodnuto o indikaci k fyziologické kardiostimulaci (stimulace převodního systému). Byl proveden takzvaný ,,upgrade“ stimulačního systému, kdy třetí elektroda je zaváděna do oblasti levého Tawarova raménka, a nahrazuje tak klasickou srdeční resynchronizační léčbu (se zavedením elektrody pro levou komoru cestou koronárního sinu a větví vena cordis magna s následnou synchronizací levé a pravé komory). Elektrokardiografie po elektrické kardioverzi a zavedení raménkové stimulace ukazují pravidelnou sekvenční síňokomorovou stimulaci ze zúžením šíře QRS komplexu (obr. 5).
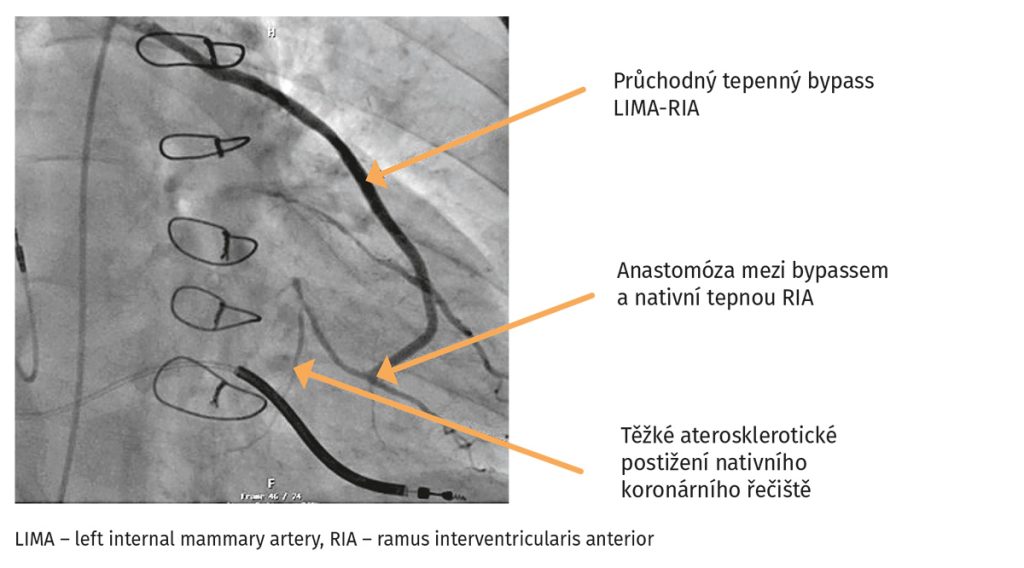
Obr. 4 Koronarografie u pacienta se zhoršením srdečního selhání
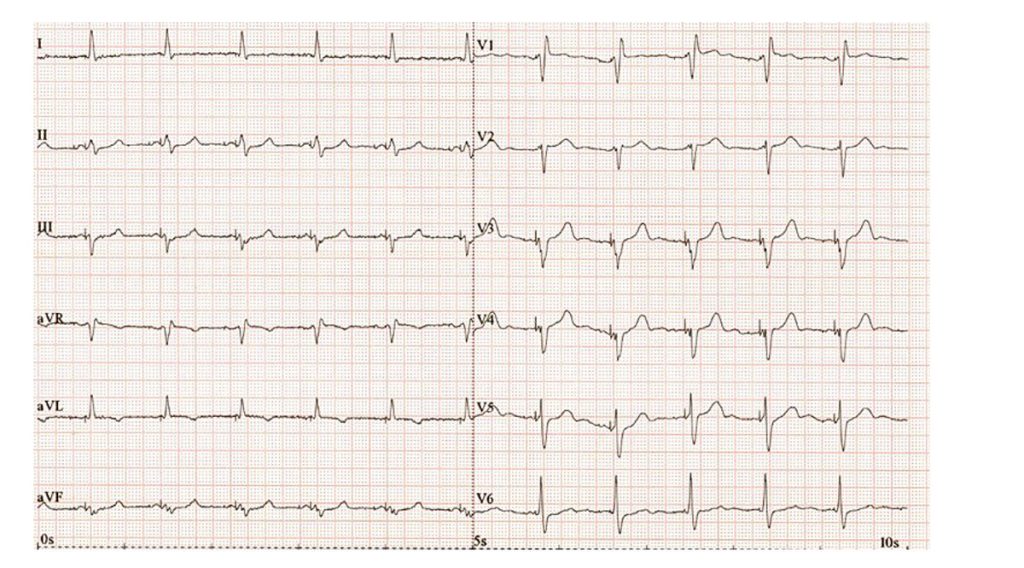
Obr. 5 EKG fyziologická stimulace
Při následné klinické kontrole v ambulanci udává pacient zlepšení symptomů. Je dušný jen při větší zátěži – chůze do schodů či do kopce, po rovině ujde bez zastavení jeden kilometr (funkční třída NYHA II). Došlo ke zmenšení otoků dolních končetin a poklesu hmotnosti zpět na původní (o dva kilogramy). Pacient neudává bolesti na hrudi, závratě nebo synkopy. Krevní tlak byl 110/63 mmHg, pravidelná tepová frekvence 69 za minutu. Došlo ke snížení koncentrace NT-proBNP postupně na 1463 ng/l jeden měsíc po terapii sakubitrilem/valsar- tanem a na hodnotu 527 ng/l pro provedení elektrické kardioverze a zavedení raménkové stimulace.
Přehled farmakoterapie pacienta ukazuje tabulka 1.
Tab. 1 Farmakoterapie pacienta s HFrEF
| empagliflozin 10 mg 1-0-0 |
| furosemid 40 mg 1-0-0 |
| spironolakton 25 mg 1-0-0 |
| bisoprolol 5 mg 1-0-1 |
| sakubitril/valsartan 49 mg/51 mg 1-0-1 |
| apixaban 5 mg 1-0-1 à 12h |
| amiodaron 200 mg tbl 1-0-0 |
| atorvastatin 80 mg 1-0-0 |
| ezetimib 10 mg tbl 1-0-0 |
| alirokumab 150 mg 1× za 14 dní s. c. |
Komentář ke kazuistice
Jedná se o poměrně typický případ pacienta s nově vzniklým srdečním selháním ischemické etiologie. Podezření na diagnózu srdečního selhání bylo v úvodu vysloveno praktickým lékařem. Vlastní diagnostika byla provedena za hospitalizace. Diagnóza byla založena na anamnéze, symptomech, známkách systémové kongesce při fyzikálním vyšetření, patologických nálezech na elektrokardiografii a rentgenu hrudníku a zvýšené koncentraci NT-proBNP.
Další krokem bylo stanovení příčiny srdečního selhání. K tomu přispěla echokardiografie s průkazem regionální poruchy kinetiky levé komory, těžké dysfunkce levé komory, funkční mitrální regurgitace a klidové plicní hypertenze. Zlatým standardem pro diagnózu ischemické choroby srdeční zůstává selektivní koronarografie, která v tomto případě prokázala významnou koronární nemoc s indikací chirurgické revaskularizace. K indikaci k chirurgické revaskularizaci a implantaci defibrilátoru v primární prevenci náhlé smrti přispěl i nález na magnetické rezonanci srdce.
Další typickou charakteristikou vývoje chronického srdečního selhání je u tohoto případu pokračující průběh onemocnění. Pacient byl po chirurgické revaskularizaci, výkonu pro fibrilaci síní a farmakoterapii dlouho klinicky stabilní. Ke zhoršení došlo zřejmě následkem recidivy fibrilace síní s intermitentní neoptimální stimulací pravé komory. Jako vhodné řešení se ukázala optimalizace farmakoterapie, elektrická kardioverze a změna stimulačního systému na ,,fyziologickou kardiostimulaci“.
Velmi efektivní se ukázala také farmakoterapie srdečního selhání. Změna z inhibitoru ACE na sakubitril-valsartan je vhodná vždy, pokud u pacienta přetrvávají symptomy a dysfunkce levé komory. V tomto případě je prostor k titraci dávky základních léků: sakubitrilu-valsartanu na 97/103 mg dvakrát denně a spironolaktonu na 50 mg denně, pokud bude pacient dávky tolerovat. Pacient je na cílové dávce bisoprololu a dávka empagliflozinu zůstává 10 mg bez nutnosti titrace.
Podávání amiodaronu je vhodné pouze dočasně vzhledem k riziku nežádoucích účinků tohoto léku při dlouhodobém užívání. V tomto případě je vhodné uvažovat o nefarmakologické léčbě perzistující fibrilace síní – katetrizační ablaci. Kromě základních léků pro terapii HFrEF zahrnuje farmakoterapie také intenzivní hypolipidemickou terapii s kombinací atorvastatinu, ezetimibu a alirokamabu (inhibitor PCSK9) pro významnou hypercholesterolemii. Pacient měl při kombinaci statinezetimib koncentraci LDL cholesterolu 3,57 mmol/l, cílovou koncentrací je u pacienta s velmi vysokým kardiovaskulárním rizikem hodnota < 1,4 mmol/l.
Tato kazuistika dokumentuje současné možnosti léčby chronického srdečního selhání. Toto onemocnění má progresivní charakter, ale díky pokrokům v diagnostice, farmakoterapii a přístrojové léčbě jsme schopni průběh tohoto onemocnění příznivě ovlivnit. Součástí péče o pacienty s CHSS je také léčba komorbidit, které jsou u pacientů se srdečním selháním časté a vyžadují speciální postupy. Proto je v péči o tyto pacienty důležitá nejen spolupráce praktického lékaře a ambulantního kardiologa, ale i lékařů dalších subspecializací (specialisté na léčbu srdečního selhání, intervenční kardiologové, arytmologové) a specialistů z jiných oborů.
Zdroj: prof. MUDr. Filip Málek, Ph.D., MBA, Srdeční selhání pro praktické lékaře,
vydalo EEZY Publishing, s.r.o., 2024.
Publikováno se souhlasem vydavatelství EEZY Publishing, s.r.o.
Foto úvodní: Freepik
Knihu si můžete zakoupit zde za zvýhodněnou cenu.

