Záchvat migrény je podle WHO zařazen do nejvyšší třídy postižení. S celosvětovou prevalencí 15–18 procent představuje migréna druhou nejvíce hendikepující diagnózu ze všech neurologických onemocnění dohromady. Přímé náklady na léčbu chronické migrény, včetně farmakologické léčby, diagnostických testů, návštěv pohotovosti a hospitalizací, jsou ve Spojených státech, Evropě a Austrálii v průměru třikrát vyšší než roční zátěž způsobená epizodickou migrénou. Chronická migréna se obvykle vyvíjí z epizodické migrény s roční mírou progrese přibližně tři procenta. Je tedy pravděpodobné, že chronická migréna je progresivní neurologické onemocnění. Zatímco chronická migréna a epizodická migréna jsou často pojímány jako poruchy stejného spektra, někteří výzkumníci a kliničtí lékaři naznačují, že chronická migréna se vyvíjí ve vlastní samostatnou klinickou jednotku s predispozicí k epizodické migréně, která představuje přibližně osm procent celkové populace migreniků. Chronická migréna přináší podstatně větší zátěž než epizodická migréna, přičemž skóre invalidity je údajně téměř dvakrát vyšší.
Migréna je charakterizována středně silnými až silnými záchvaty jednostranné pulzující bolesti hlavy spojenými s fotofobií, fonofobií, nevolností a/nebo zvracením, které obvykle trvají 4 až 72 hodin. Pacient s chronickou migrénou musí být postižen bolestmi hlavy nejméně 15 dní v měsíci po dobu nejméně tří měsíců, kdy nejméně osm z těchto bolestí hlavy splňuje kritéria migrény. Epizodická migréna se proto od chronické migrény liší sníženou frekvencí bolestí hlavy/migrény a běžně zahrnuje ~1–2 migrény/bolesti hlavy za měsíc.
Fáze migrenózního cyklu
Obecně se migrenózní záchvat skládá ze tří fází: premonitorní fáze, samotná migréna a postdromální fáze. Premonitorní fáze nastává 24–48 hodin před fází bolesti hlavy a je typicky charakterizována příznaky, jako jsou změny nálady, podrážděnost, přecitlivělost na světlo, nepříjemné pocity v krku, zívání, zvýšená frekvence močení, žízeň, touha po jídle nebo po sladkém, bolest šíje a kognitivní dysfunkce. Kromě toho se přibližně u třetiny migreniků vyskytuje aura, která se skládá z přechodných fokálních neurologických příznaků zrakových, senzorických nebo motorických poruch, které se mohou objevit současně s premonitorní fází nebo fází migrény. Na fázi bolesti hlavy navazuje postdromální fáze, která trvá 72 hodin a je charakterizována příznaky nesouvisejícími s bolestí hlavy, jako je únava, potíže se soustředěním a ztuhlý krk. Bezbolestné a bezpříznakové interiktální období mezi záchvaty migrény může mít různou délku v závislosti na chronicitě migrény. S ohledem na vysokou frekvenci záchvatů a závažnost symptomů chronické migrény je pravděpodobné, že osoby trpící migrénou jsou trvale ve fázi podobné migréně a/nebo premonitorní fázi s omezeným neurologickým zotavením a obnovením základního stavu mezi záchvaty.
Mechanismy související s přechodem od epizodické migrény k chronické jsou složité. Mezi rizikové faktory přechodu patří vysoká výchozí frekvence epizodických migrenózních záchvatů, nadměrné užívání akutních léků, obezita, stresové životní události, pohlaví a nižší socioekonomický status. Migréna postihuje častěji ženy než muže (v poměru 3 : 1). Kromě toho se u chronických migreniků častěji vyskytují komorbidní psychiatrické poruchy, jako je úzkost, deprese, obtíže s mluvením i čtením.
Modifikace rizikových faktorů prostřednictvím hodnocení je pro léčbu bolestí hlavy zásadní a lepší pochopení chronického průběhu migrény může dále pomoci při vývoji selektivních terapeutik, která usnadní účinnou terapii a léčbu chronické migrény. Současná léčba epizodické migrény je u chronických migreniků často neúčinná a může dále zvyšovat intenzitu a četnost migrenózních záchvatů.
Patofyziologie chronické migrény
Teorie vzniku migrény se v průběhu času vyvíjely, aniž by došlo ke shodě ohledně její patofyziologie. V současné době existují dva hlavní směry, pokud jde o základní mechanismus vzniku migrény obecně. Jeden směr předpokládá, že migréna vzniká v důsledku vnějších spouštěčů, a druhý, že migréna vzniká převážně v důsledku změn v mozku samotném (obr. 1).
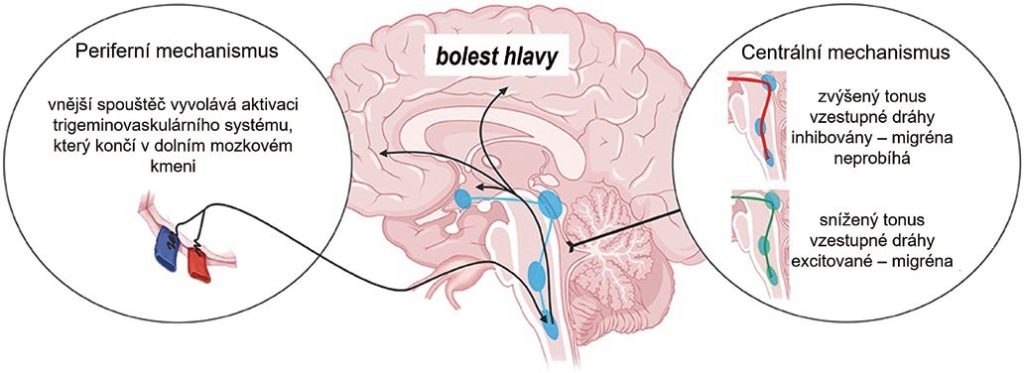
Obr. 1 Centrální vs. periferní mechanismus migrény.
Zdroj obrázku: Mungoven TJ, Henderson LA, Meylakh N. Chronic migraine pathophysiology and treatment: a review of current perspectives.. Frontiers in Pain Research. 2021;2:705276.
Dřívější teorie vzniku migrény vycházela z hypotézy, že k iniciaci migrenózních záchvatů dochází prostřednictvím aktivace perivaskulárních nervů inervujících hlavní mozkové cévy. Zatímco cerebrovaskulární změny byly po určitou dobu považovány za základ patofyziologie migrény, v poslední době se objevily důkazy o rozhodující roli nervových změn v subkortikálních místech při vzniku migrény. Až u 80 procent migreniků se první příznaky (jako je únava a problémy s koncentrací) vyskytují ještě před tím, než začne bolest hlavy, a to i několik hodin až dnů předem.
Studie na zvířecím modelu prokázaly, že aktivace neuronů trigeminovaskulárního systému v mozkovém kmeni, které se podílejí na migrenózní bolesti, může být vyvolána změnami v mozkové kůře, a to bez potřeby vnějších podnětů. Dysfunkce ve specifických oblastech mozku, konkrétně pod kortexem a pod úrovní mezimozku (diencephalon), může ovlivňovat způsob, jakým mozek zpracovává běžné signály, které se pohybují mezi těmito oblastmi. Aktivita mozkového kmene osciluje mezi stavy zvýšeného, prahového a sníženého nervového „napětí“. Když je mozkový kmen ve stavu sníženého tonu, probíhající endogenní analgetické obvody jsou málo efektivní při modulaci příchozích škodlivých vstupů a vnější spouštěč může aktivovat trigeminální dráhy a vyvolat tak bolest hlavy. Naopak když je tonus mozkového kmene zvýšený (vyšší nervová aktivita), systémy pro regulaci bolesti jsou efektivnější. V tomto stavu je mozek schopný lépe modulovat příchozí signály bolesti. Také hypotalamus může ovlivňovat citlivost oblastí mozkového kmene, které se podílejí na modulaci bolesti přicházející z trigeminálního nervu.
Migréna představuje komplexní onemocnění se synergickým vztahem mezi periferním a centrálním nervovým systémem, které se společně podílejí na jejím vzniku. Přestože periferní a centrální mechanismy mohou existovat současně, rovnováha mezi těmito faktory se může u jednotlivých migreniků lišit. Navíc je pravděpodobné, že podíl centrálních a periferních mechanismů na vznik migrény se mění, když jedinec přechází z epizodické migrény na chronickou, nebo se mění v průběhu času. Při transformaci, iniciaci a udržování chronické migrény mohou hrát roli strukturální a funkční změny mozku v oblastech souvisejících s bolestí, atypické zpracování bolesti, kortikální hyperexcitabilita, centrální senzitizace a neurogenní zánět.
Nadužívání léků při chronické bolesti hlavy
Diagnostiku chronické migrény a posuzování její patofyziologie komplikuje skutečnost, že její symptomy se mohou snadno zaměnit za projevy bolesti hlavy způsobené nadužíváním léků (medication overuse headache, zkráceně MOH). Pro MOH jsou charakteristické bolesti hlavy trvající nejméně 15 dní v měsíci. Tyto bolesti mohou být spojeny s již existující migrénou nebo tenzní bolestí hlavy a jsou důsledkem častého užívání analgetik nebo jiných léků proti bolesti na úlevu od původní bolesti hlavy. Nadměrné užívání triptanů, opioidů a kombinovaných analgetik k léčbě migrény vede k chronifikaci bolesti hlavy rychleji než nadměrné užívání jednoduchých analgetik (například paracetamolu nebo ibuprofenu). Riziko vzniku MOH se také zvyšuje u jedinců s rodinnou anamnézou MOH nebo nadužívání návykových látek. U přibližně 60–80 procent těchto pacientů představuje migréna základní poruchu, a proto lze předpokládat, že se na vzniku MOH podílí dědičnost a specifické mechanismy spojené s užíváním léků.
Preklinický model simulující podmínky migrénózní bolesti při chronickém užívání léků ukázal, že dlouhodobé vystavení látkám, které stimulují specifické serotoninové 5-HT1F receptory zodpovědné za přenos bolestivých signálů z obličeje a hlavy do mozku, mohou mít riziko indukce MOH. Oproti tomu látky blokující CGRP receptory toto riziko nezvyšují. Tento efekt je podobný účinkům běžného léčiva na migrénu – sumatriptanu, který rovněž ovlivňuje citlivost nervů. I když jsou tyto léky účinné při léčbě migrény, jejich časté užívání zvyšuje riziko rozvoje MOH.
Porovnáním chronických migreniků s MOH a bez ní byly zjištěny významné rozdíly v objemech šedé hmoty v orbitofrontální a parahipokampální oblasti. Jedinci s MOH vykazovali větší objem v oblasti mozku související se zpracováním bolesti a schopností zmírňovat bolest (antinocicepcí), jako je periakveduktální šedá hmota středního mozku (PAG), a menší objem v orbitofrontální kůře. Bylo prokázáno, že po 12 měsících „detoxikace“ se objem PAG vrátil na kontrolní úroveň pouze u těch, u nichž se snížila frekvence bolestí hlavy. Objemové změny v některých oblastech jsou tedy reverzibilní a souvisejí s nadužíváním léků.
Ing. Jana Brabcová, Ph.D.
Foto: 123rf.com
Pokračování zde…

