Senzibilizace trigeminálního systému a neurogenní zánět
Za klíčový faktor pro vznik chronické migrény je považována senzibilizace trigeminálních aferentních nervů, které přenášejí bolestivé signály z oblasti hlavy a obličeje. Osoby trpící chronickou migrénou mají významné zvýšení exprese receptoru TRPV1 v nervových vláknech, která inervují stěny cév na pokožce hlavy. Receptory TRPV1 aktivují trigeminovaskulární systém a dochází k uvolnění látek – CGRP (kalcitoninový genový peptid) a substance P, které zvyšují zánět a citlivost na bolest. Nervy se tak stávají přecitlivělými a přenášejí bolest intenzivněji.
Na krysím modelu bylo prokázáno, že zvýšené hladiny CGRP a VIP (vazoaktivní střevní peptid) mohou být indikátorem účinnosti injekcí botulotoxinu typu A při léčbě migrény. Po aplikaci injekcí dochází k redukci počtu TRPV1-pozitivních neuronů v trigeminálním ganglionu a snížení citlivosti nervů zodpovědných za přenos bolestivých signálů. Vyšší koncentrace těchto peptidů tak mohou predikovat lepší odpověď na tuto terapeutickou
léčbu.
U pacientů s chronickou migrénou jsou mezi jednotlivými záchvaty migrény zaznamenány vyšší hladiny určitých neuropeptidů v krvi, které hrají roli v neurogenní zánětlivosti, bolesti a jsou spojeny se změněnou funkcí trigeminálního nervu. Tyto neuropeptidy zahrnují CGRP a vazodilatační peptidy VIP a PACAP-38. Mohou být klíčovými mediátory neurogenního zánětu, kdy je zánět vyvolán nervovým systémem namísto infekce či poranění.
PACAP-38 je rozšířen v oblastech mozku, které jsou zodpovědné za regulaci bolesti hlavy, jako je hypofýza, mozkový kmen, hypotalamus a kůra mozková. Klinické studie ukázaly, že infuze PACAP-38 dokáže vyvolat migrénu u 73 procent pacientů s migrénou bez aury. Naproti tomu VIP-indukovaná vazodilatace kraniálních tepen nedokázala spustit záchvat migrény u pacientů s migrénou a způsobila pouze mírnou, krátkodobou bolest hlavy u zdravých subjektů. Infuze PACAP-38 vyvolává fotofobii, meningeální dilataci a zvyšuje nervovou aktivaci v trigeminálních gangliích a spinálním trigeminálním jádře (SpV) u myší divokého typu ve srovnání s myšmi s deficitem PACAP-38. Tyto výsledky objasňují úlohu PACAP-38 v patofyziologii migrény. Pokud je PACAP-38 v těle přítomen dlouhodobě ve vysokých hladinách, může přispívat k přechodu migrény do její chronické formy.
V mechanismech migrény jsou zapojené i kanály citlivé na adenosin 5′-trifosfát (KATP) prostřednictvím své vazodilatační exprese v kraniálních tepnách, trigeminálním gangliu a SpV. V těchto oblastech dochází k rozšíření cév a ke vzniku migrenózní bolesti. Intravenózní infuze syntetického KATP (levkromakalim) v klinických studiích vedla k rozšíření extracerebrálních tepen a vyvolala bolest hlavy u subjektů bez migrény, zatímco záchvaty migrény byly generovány u pacientů s migrénou s aurou i bez aury. Otevření KATP kanálů může být potenciálně novou signální cestou, která vyžaduje další zkoumání v souvislosti s patofyziologií migrény.
Histologické analýzy ukazují, že vlákna trigeminálního nervu jsou uspořádána jinak než u zdravých jedinců. Kromě toho magnetická rezonance (MR) odhalila změny v objemu trigeminálního nervu, což naznačuje, že struktura tohoto nervu je u pacientů s migrénou odlišná od normální struktury.
Migréna je často spojena s orofaciálními bolestivými stavy, jako jsou temporomandibulární poruchy (TMD), problémy s čelistním kloubem a svaly obličeje. Proto podobné základní patofyziologické mechanismy mohou být společné pro migrénu a tyto orofaciální bolesti. Téměř dvě třetiny všech jedinců s chronickými každodenními bolestmi hlavy měly souběžnou TMD. Souvislost mezi bolestivou TMD a bolestí hlavy byla hlášena jako nejvyšší u chronické migrény. Lidé s chronickou migrénou tak mají větší pravděpodobnost, že budou mít také problémy s čelistním kloubem.
V samotném trigeminálním gangliu navíc probíhají procesy, které se mohou podílet na chronické migréně (obr. 2). Sekrece CGRP z trigeminálního ganglia pravděpodobně reguluje senzorické zpracování a vyvolává periferní vazodilataci působením na receptory CGRP v buňkách hladké svaloviny meningeální vaskulatury, které následně vedou k uvolňování dalších neuropeptidů, jež společně zprostředkovávají meningeální neurogenní zánět.
Na chronické migréně se navíc pravděpodobně podílí i senzibilizace vzestupných trigeminálních drah v mozku samotném. Předpokládá se, že tato centrální senzitizace je základem přítomnosti kožní alodynie u chronické migrény, která je častější a závažnější než ta u jedinců s epizodickou migrénou. Je zajímavé, že u chronických migreniků se projevuje jak cefalická, tak extracefalická alodynie, svědčící o senzibilizaci neuronů v SpV, kde nejprve končí noxické aferenty inervující hlavu a ústní dutinu, a také ve vyšších oblastech mozku, jako je thalamus, který obsahuje reprezentaci noxických vstupů z celého těla. Centrální senzitizace může být také příčinou vyšší frekvence záchvatů a intenzity bolesti, tedy rizikových faktorů pro rozvoj kožní alodynie u migreniků. Kožní alodynie může být také základem chronifikace migrény. Prevence nebo zvrácení centrální senzi-
bilace tak může snížit migrenózní bolest a míru přechodu do chronické migrény.
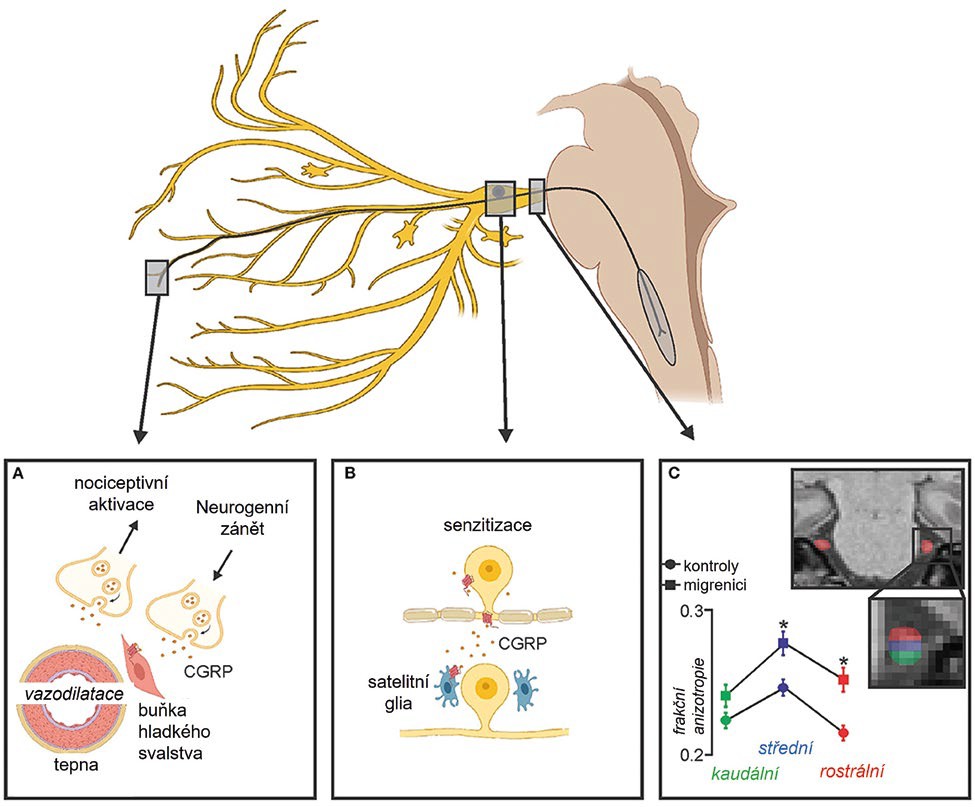
Obr. 2 Periferní změny při migréně: (A) uvolněný CGRP působí na hladké svalové buňky; (B) CGRP sekretovaný z trigeminálního ganglia interaguje s přilehlými CGRP receptory na satelitních gliích; (C) změny objemu trigeminálního nervu a difuzivity volné vody, které jsou patrné u pacientů s epizodickou migrénou ve srovnání se zdravými kontrolami
Zdroj obrázku: Mungoven TJ, Henderson LA, Meylakh N. Chronic migraine pathophysiology and treatment: a review of current perspectives.. Frontiers in Pain Research. 2021;2:705276.
Funkční změny mozku u chronické migrény
Kromě centrální senzibilizace se s postupujícím onemocněním migrény stává trvalou aktivace a senzibilizace trigeminální dráhy a souvisejících bolestivých okruhů v mozku. Tento stav může dále přispívat ke strukturální a funkční reorganizaci okruhů souvisejících s bolestí u chronických migreniků, a zvyšovat tak jejich citlivost k rozvoji častějších záchvatů, které tím ve většině případů obcházejí interiktální fázi.
Mozkový kmen
Nervy inervující mozkové cévy a tvrdou plenu mozkovou vstupují do mozku prostřednictvím trojklanného nervu a končí v SpV. Preklinické studie ukázaly, že tato vlákna inervují široký rozsah. Neurony druhého řádu pak kontaktují více míst v mozkovém kmeni, včetně oblastí, o nichž je známo, že modulují příchozí škodlivé vjemy, jako je PAG. PAG a její projekce do rostrální ventromediální dřeně (RVM) tvoří páteř výkonného systému modulace bolesti v mozku, který ovlivňuje intenzitu bolesti prostřednictvím aktivace nebo inhibice projekčních neuronů v SpV. Předpokládá se, že dysregulace RVM se podílí na iniciaci migrény a že modulace dráhy PAG-RVM-SpV může buď iniciovat migrénu posílením bazální vzestupné noxické aktivity, nebo alternativně poskytnout prostředí, kterým může spouštěč vyvolat migrenózní bolest hlavy.
Hypotalamus
U chronických migreniků užívajících léky, kteří byli skenováni v průběhu bolesti hlavy, byla ve srovnání s interiktálními epizodickými migreniky prokázána zvýšená funkční konektivita mezi předním hypotalamem a SpV. Podobně chroničtí migrenikové, u kterých bylo vyšetření provedeno při probíhající bolesti hlavy, vykazovali ve srovnání s kontrolami silnější aktivaci předního hypotalamu v reakci na bolestivou stimulaci trigeminu a SpV v reakci na zrakové podněty. Tyto výrazné funkční změny mohou hrát roli při vzniku a chronifikaci migrenózního záchvatu.
Hypotalamus vykazuje změněné vzorce klidové aktivity bezprostředně před migrénou a větší aktivaci během noxní stimulace u epizodických a chronických migreniků během iktální fáze. Během iktální fáze je prokazatelně zvýšeno funkční propojení hypotalamu s dorzálním ponsem ve srovnání s obdobím tři dny před nástupem bolesti hlavy, z čehož lze usuzovat na potenciální mechanismus udržování migrenózní bolesti. Nedávno bylo zjištěno, že po trigeminální nocicepci je hypotalamická aktivace přítomná 48 hodin před vznikem migrenózní bolesti hlavy.
Změny aktivity v určitých oblastech mozku (hypotalamus, PAG, RVM, SpV) těsně před migrenózním záchvatem mohou být způsobeny zvýšenou aktivitou astrocytů, které mohou ovlivnit přenos informací mezi neurony a aktivovat vápníkové vlny, které oscilují na podobné frekvenci. Modifikace synaptické aktivity astrocytů by tedy mohla být jedním z faktorů spouštějících migrenózní záchvaty. Navíc osoby s chronickou migrénou, z nichž většina trpěla nespavostí, měly změněnou cirkadiánní sekreci hormonů. Mezi ně patří snížený noční nárůst prolaktinu, opožděný nárůst melatoninu a zvýšená hladina kortizolu. U chronické migrény jsou tak patrné abnormální vzorce hypotalamické hormonální sekrece.
Mozková kůra
Mimo změněnou schopnost modulace bolesti se předpokládá, že chronická migréna je podmíněna zvýšenou excitabilitou mozkové kůry. V souladu s touto hypotézou nedávné studie fMRI v klidovém stavu zjistily, že chroničtí migrenici vykazují změněnou koherenci několika hlavních vnitřních mozkových sítí, včetně sítí salience, centrální exekutivy, dorzální pozornosti a výchozího režimu. Větší závažnost bolesti hlavy byla také spojena se zvýšenou silou konektivity dorzálního systému pozornosti a nižší silou sítě exekutivní kontroly, z čehož vyplývá, že chronická migréna je charakterizována maladaptivními změnami plasticity kortikální sítě. Uvedená pozorování funkčních změn naznačují, že u chronických migreniků dochází k aberantnímu zpracování bolesti v důsledku změněné sestupné modulace bolesti.
Ing. Jana Brabcová, Ph.D.
Foto: 123rf.com

